COMPOSTOS ORGÂNICOS OXIGENADOS - ÁLCOOL
Função Orgânica: Álcool
Um álcool é
um composto que possui uma hidroxila ou oxidrila (OH) ligado a um carbono
saturado (R – OH).
Etanol
·
Aplicamos em diversas áreas, mas é mais comum nos setores de bebidas e
limpeza.
·
Há diversos tipos de álcoois: com cadeia saturada, instaurada, normal,
ramificada e fechada.
Ligações
·
O oxigênio presente na hidroxila consegue atrair para si os elétrons, já
que apresenta alta propriedade eletronegativa e, por isso, o hidrogênio fica
com carga positiva.
·
Assim, os álcoois são propensos a ligações, e consequentemente muito
reativos.
·
Fórmula Geral:
o
CnH2n + 2O ou CnH2n
+1OH
Classificação
·
Os álcoois são classificados de duas maneiras.
o
Classificação quanto à posição da hidroxila.
o
Classificação quanto ao número de hidroxilas.
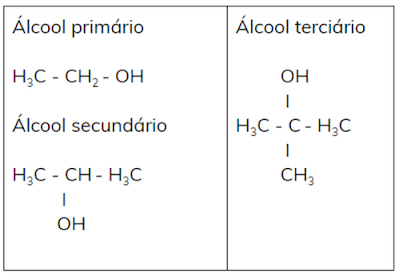
Posição da
hidroxila
· Álcool primário: OH ligado a um carbono primário.
·
Álcool secundário: OH ligado a um carbono secundário.
·
Álcool terciário: OH ligado a um carbono terciário.
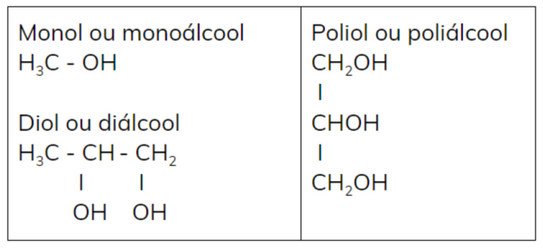
Número de
hidroxilas
·
Monol ou monoálcool: apenas uma hidroxila.
·
Diol ou diálcool: duas hidroxilas.
·
Poliol ou poliálcool: mais de duas hidroxilas.
Nomenclatura dos Álcoois
Existem
duas maneiras para denominar os álcoois.
Nomenclatura
oficial (IUPAC)
· Prefixo (número de carbonos) + tipo de ligação + OL
·
Ordem para numeração da cadeia: grupo funcional; insaturação; radical.
·
Exemplo 1:
o
H3C - CH2 - OH
o
Et → 2
carbonos
o
an → só
ligações simples
o
ol →
álcool
§
Etanol
Nomenclatura
oficial (IUPAC)
·
Exemplo 2:
o
Propan-2-ol.
Nomenclatura
usual
·
Álcool + Nome do radical correspondente + ico
·
Exemplo 1:
o
H3C – OH
o
Álcool Metil (1 carbono) + ico = Álcool metílico
·
Exemplo 2:
o
H3C - CH2 - OH
o
Álcool Etil (2 carbonos) + ico = Álcool etílico
Propriedades Físicas dos
Álcoois
Por conta
de suas propriedades, os álcoois possuem grande aplicação no âmbito industrial.
As ligações entre suas moléculas influenciam suas propriedades físicas.
Pontos de
fusão e ebulição
·
Os álcoois possuem altos pontos de fusão e ebulição por possuírem
ligações de hidrogênio na hidroxila.
·
Isto é, necessitam de grandes quantidades de energia para alcançar um
outro estado físico.
Polaridade
·
O grupo funcional (OH) apresenta característica polar (seu polo elétrico
é formado por meio de ligação eletrônica).
·
A cadeia carbônica tem característica apolar (não tem polo).
o
Se a cadeia carbônica é maior, o álcool fica mais apolar.
o
Se possuir mais grupos funcionais, o álcool fica mais polar.
Solubilidade
·
Os álcoois que apresentam menos carbonos na cadeia (etanol e metanol)
são solúveis, pois são polares.
·
Os álcoois que apresentam maior cadeia são insolúveis, pois são mais
apolares.
Estado
físico e densidade
·
A hidroxila faz com que a substância apresente mais viscosidade
(propriedade de um fluido resistir ao escoamento).
·
Monoálcoois com até 12 carbonos são líquidos, enquanto os poliálcoois
com mais de 5 carbonos são sólidos.
·
Grande parte dos álcoois apresenta densidade menor que a água.
Aplicações dos Álcoois
Veremos a
seguir as aplicações dos álcoois que mais se destacam em nosso cotidiano.
Etanol
·
As bebidas alcoólicas são feitas através da fermentação dos açúcares de
um insumo.
o
Por exemplo, utiliza-se a fermentação da cana para fazer a cachaça.
o
A vodca é feita por meio da fermentação da batata, por exemplo.
o
O uísque é produto da fermentação de grãos.
·
O teor alcoólico do tipo de bebida pode variar como: 5% (cerveja), 50%
(cachaça) e 80% (absinto).
Etilenoglicol
·
O etilenoglicol é um aditivo usado para arrefecimento (refrigeração)
pelo fato de seu ponto de fusão ser −12,9°C, e ebulição em 197,3°C.
·
Assim, é sendo utilizado como anticongelante para motores a combustão e
para elevar o ponto de ebulição de substâncias aquosas.
·
Diferente do etanol, é uma substância tóxica imprópria para o consumo.
Etanol
·
O etanol brasileiro é proveniente da fermentação de cana-de-açúcar, mas,
em outros países, como nos EUA, é derivado do milho.
·
Utiliza-se em combustíveis puros, motores e é adicionado à gasolina.
Metanol
· O metanol é um composto tóxico e corrosivo que é resultado da oxidação do gás metano, oriundo da destilação do petróleo, quando catalisadores são usados. Utiliza-se em motores a combustão e é também fundamental para síntese de formaldeído e biodiesel.
Bons estudos! Um mol de abraços!


















Comentários
Postar um comentário
Obrigado por participar!! :)